清華大學攻破干細胞最大難題!全新藥物使干細胞功...
在所有現存科技中,干細胞是最有可能把人類帶向永生的生物技術。
作為細胞的“始祖”,干細胞能夠通過釋放外泌體或親自上陣,對受損的細胞進行保護、修復、甚至替換[1]。理論上講,成熟的干細胞療法近乎能夠復原衰老在人體中造成的任何損害。
如此一來,“只要我修的夠快,損傷累積不起來,衰老也就不會發生”。這就是目前絕大多數再生醫學派人員所堅信的抗衰老之道。

 De Grey博士便是這其中的代表人物
De Grey博士便是這其中的代表人物拋開衰老是否真的僅僅就是損傷累積這么簡單不說,干細胞現在依然沒有在大型微商以外的領域得到廣泛的應用,主要因為這種技術依然存在幾個關鍵的技術難題沒有攻克:
其中最首要也是最尷尬的問題,就是注入體內的干細胞過于自由散漫,在體內四處閑逛,能不能游走到損傷處,基本是“三分靠打拼七分天注定”[2]。如此一來如果僅僅是損傷得不到修復,幾十萬白花了還好說,干細胞飄到不該去的地方變成腫瘤[3],才真的是腸子都悔青。
▼
2020年11月20日,在一項清華大學參與的國際研究中,科學家們開發出了一種全新藥物,能夠精準的把注入體內的干細胞牽引至需要修復的部位,直接攻克了干細胞療法的最大難題之一。該成果發表在了頂級科研期刊《PNAS》上[4]。

 這項研究于2020年11月20日發表在頂級科研期刊《PNAS》上
這項研究于2020年11月20日發表在頂級科研期刊《PNAS》上研究人員發現,有一種名為CXC12蛋白質,似乎對干細胞有著異常強大的吸引力。但是由于CXC12本身具有極強的促炎能力,想要把這種物質注射進體內的損傷處來牽引干細胞,無異于往傷口上涂火鍋底料。

 疼
疼結構分析顯示,整個CXC12蛋白其實可以大致的分為兩塊結構,結構A負責與受體結合,是吸引干細胞的關鍵,而結構B則負責觸發細胞事件,也就是促炎根源。既然兩項功能分的清清楚楚,研究人員索性對CXC12蛋白進行了一番生物改造,在保證CXC12基本形態不變的前提下,大幅的削弱了結構B,并強化了結構A。
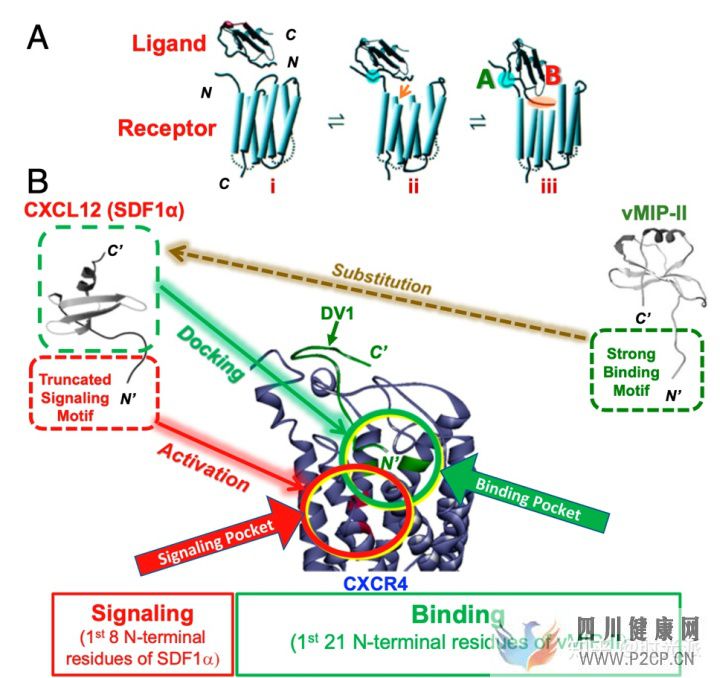
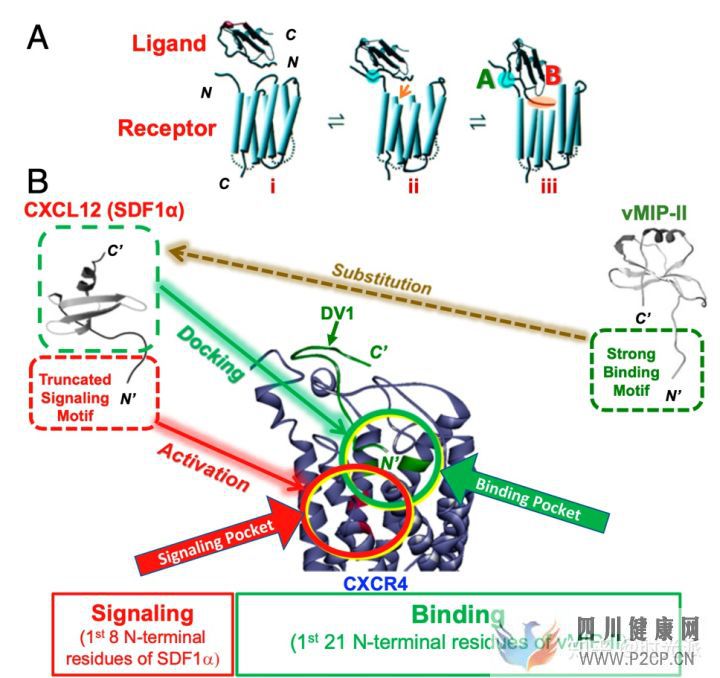 疼
疼這種改造而來的全新物質被命名為SDV1a。
在第一波細胞實驗中,動力學分析顯示SDV1a對人類神經干細胞確實有極強的吸引力,而基因表達測量則指出,SDV1a基本完全喪失了引發炎癥所需要的能力,并且引發與干細胞功能等相關基因表達的能力得到了大幅加強。
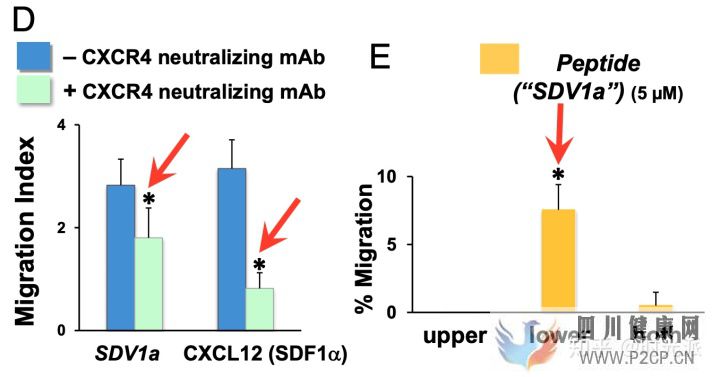
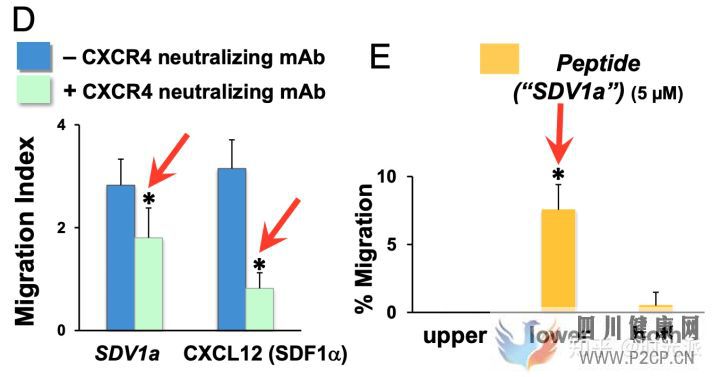 SDV1a對干細胞的牽引能力極強
SDV1a對干細胞的牽引能力極強SDV1a的表現在后續的活體實驗中甚至更加驚艷,研究人員直接將SDV1a無創注射進了小鼠大腦中的海馬體中,這一埋藏在復雜大腦最深處的區域,通常是干細胞最難以到達的地方。然而一針SDV1a下去,補充進小鼠體內的人類神經干細胞,幾乎全部都進入并停留在了海馬體中。
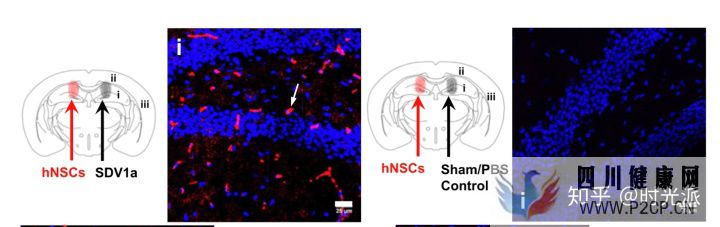
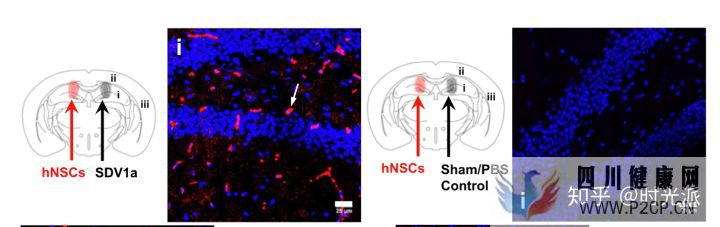 SDV1a將補充的神經干細胞全部牽引到了小鼠的海馬體中
SDV1a將補充的神經干細胞全部牽引到了小鼠的海馬體中接下來是最令人擔心的副作用,一番測量,干細胞分化傾向改變、腦血屏障損傷、腫瘤生成、細胞結構異常、器官交通紊亂、細胞分布變化,還有不正常細胞死亡等等等等,研究人員可謂是把能想到的潛在風險全都測了一遍,然而,什么都沒有發生。SDV1a在活體實驗中,沒有表現出任何毒副作用。
超強的牽引力,還毫無副作用,這么完美的藥物,按理來說是只能存在于微商圈的,SDV1a是不是真的攻克了干細胞牽引難題,必須要看一下實戰結果。
▼
研究人員借著優秀數據帶來的自信,直接選擇了神經干細胞療法中難度最高的病理模型,溶酶體貯積病(LSD)作為了自己的演練場。想要通過干細胞治療這類神經疾病,所使用的療法不僅需要最大限度的將干細胞牽引并穩定在病灶處,而且炎癥反應不能出現任何進一步的增強,否則要么治療無效,要么病情加重。
預先在病灶處注射過SDV1a的患病小鼠,對干細胞治療的反應出現了成倍的提升,大腦中Hexβ等關鍵病理特征出現了顯著改善。如果僅從最終存活率和發病時間這兩種最直觀的數據來看的話,SDV1a將干細胞療法的功效提升了近乎一倍。副作用?依然什么都沒有。
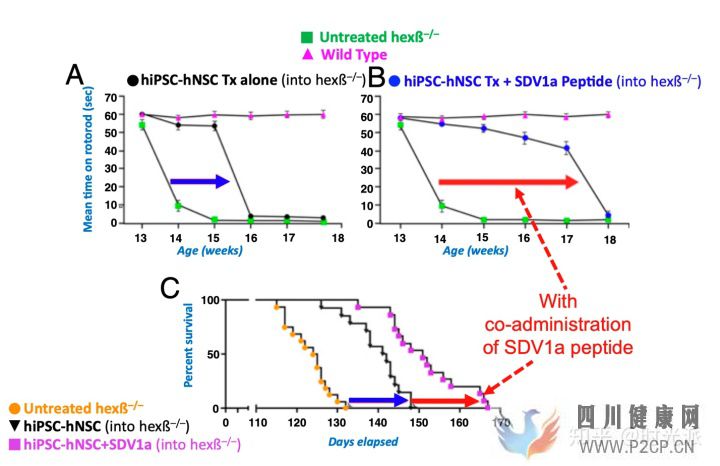
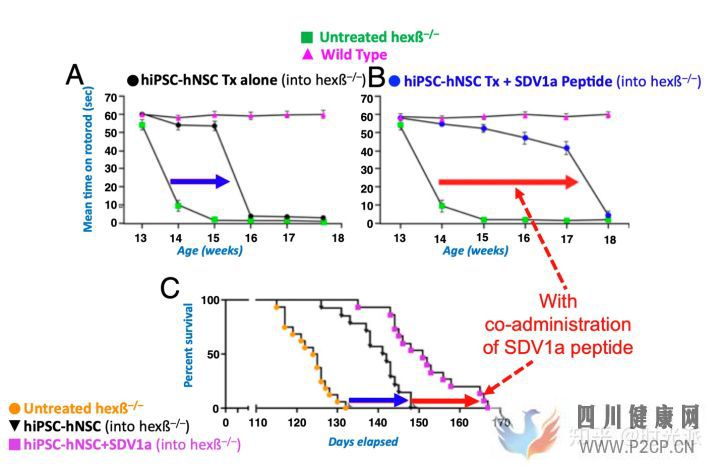 SDV1a將干細胞療法的功效提升了近乎一倍
SDV1a將干細胞療法的功效提升了近乎一倍時光派點評
抱歉要給大家潑個涼水,解決了牽引問題,擋在干細胞應用面前的大山還有好幾座。
比如就在一個月前,干細胞領域的權威,諾獎得主山中伸彌教授剛剛在《Cell》子刊上發表了自己對于干細胞(誘導多能干細胞)技術的展望,山中教授在文中重點提及了三個急需攻克的難題,異質性(heterogeneity)、致瘤性(tumorigenicity),和免疫原性(immunogenicity)[5],哪一個單拿出來,都能讓無數科學家愁禿了腦門。
不過如果SDV1a的有效性和安全性能夠在今后得到更進一步確認,并且順利通過臨床檢測,那么毫不夸張的說,這次的研究真的是將干細胞技術向前推進了巨大的一步,同時也把我們與健康長壽之間的距離縮短了一大截。
▼
科學就是這樣,難題一個接一個,不過最后總能被解決。


參考文獻(滑動查看)
[1]. Teng, Y. D., Benn, S. C., Kalkanis, S. N., Shefner, J. M., Onario, R. C., Cheng, B., . . . Snyder, E. Y. (2012). Multimodal Actions of Neural Stem Cells in a Mouse Model of ALS: A Meta-Analysis. Science Translational Medicine, 4(165). doi:10.1126/scitranslmed.
[2]. Karp, J. M., & Teo, G. S. (2009). Mesenchymal Stem Cell Homing: The Devil Is in the Details. Cell Stem Cell, 4(3), 206-216. doi:10.1016/j.stem.2009.02.001
[3]. Malchenko, S., Xie, J., Bonaldo, M. D., Vanin, E. F., Bhattacharyya, B. J., Belmadani, A., . . . Soares, M. B. (2014). Onset of rosette formation during spontaneous neural differentiation of hESC and hiPSC colonies. Gene, 534(2), 400-407. doi:10.1016/j.gene.2013.07.101
[4]. Lee, J., Zhang, R., Yan, M., Duggineni, S., Wakeman, D. R., Niles, W. L., . . . Snyder, E. Y. (2020). Chemical mutagenesis of a GPCR ligand: Detoxifying “inflammo-attraction” to direct therapeutic stem cell migration. Proceedings of the National Academy of Sciences, . doi:10.1073/pnas.
[5]. Yamanaka, S. (2020). Pluripotent Stem Cell-Based Cell Therapy—Promise and Challenges. Cell Stem Cell, 27(4), 523-531. doi:10.1016/j.stem.2020.09.014
|時光派原創出品 未經授權嚴禁轉載





